在一项国际,随机,双盲,主动对照试验(COMBI-d研究; NCT01584648)中评估了与Tafinlar达拉非尼(dabrafenib)联合使用的Mekinist曲美替尼(Trametinib)的安全性和疗效。COMBI-d研究比较了Tafinlar达拉非尼(dabrafenib)加Mekinist曲美替尼(Trametinib)与Tafinlar达拉非尼(dabrafenib)加安慰剂作为一线治疗不可切除(IIIc期)或转移性(IV期)BRAF V600E或V600K突变阳性的皮肤黑色素瘤患者的一线治疗。患者被随机分配(1:1)接受Mekinist曲美替尼(Trametinib) 2 mg每天一次,加Tafinlar达拉非尼(dabrafenib) 150 mg每天两次,或Tafinlar达拉非尼(dabrafenib) 150 mg每天两次,加上匹配的安慰剂。根据LDH水平(大于ULN vs.≤ULN)和BRAF突变亚型(V600E vs. V600K)对随机分组。根据RECIST v1,主要疗效结果是研究者评估的无进展生存期(PFS)。
在COMBI-d研究中,将423例患者随机分为Mekinist曲美替尼(Trametinib)加Tafinlar达拉非尼(dabrafenib)(n = 211)或Tafinlar达拉非尼(dabrafenib)加安慰剂(n = 212)。中位年龄为56岁(范围:22至89岁),男性53%,白人> 99%,ECOG表现为0的72%,IIIc期为4%,M1c疾病为66%,EcG疾病为65% LDH正常,2例有脑转移史。所有患者均患有含有BRAF V600E或V600K突变的肿瘤,这是通过与FDA批准的伴随诊断测试进行集中测试确定的;85%的患者患有BRAF V600E突变阳性黑色素瘤,而15%的患者患有BRAF V600K突变阳性黑色素瘤。
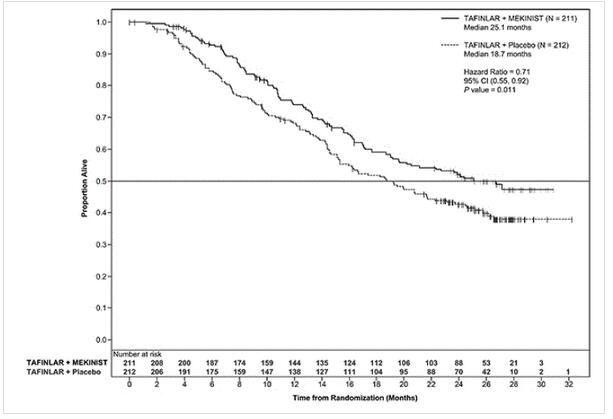
COMBI-d研究表明,PFS和OS的改善具有统计学意义。下表和下图总结了功效结果。
表:COMBI-d研究的疗效结果
| 终点 | MEKINIST加上Dabrafenib N = 211 | 安慰剂加Dabrafenib N = 212 |
| 无进展生存期一 | ||
| 活动数量(%) | 102(48%) | 109(51%) |
| 中位数,月(95%CI) | 9.3(7.7,11.1) | 8.8(5.9,10.9) |
| 人力资源(95%CI) | 0.75(0.57,0.99) | |
| P值b | 0.035 | |
| 整体生存 | ||
| 死亡人数(%) | 99(47%) | 123(58%) |
| 中位数,月(95%CI) | 25.1(19.2,NR) | 18.7(15.2,23.1) |
| 人力资源(95%CI) | 0.71(0.55,0.92) | |
| P值b | 0.01 | |
| 总体回应率a | ||
| ORR(95%CI) | 66%(60%,73%) | 51%(44%,58%) |
| P值 | <0.001 | |
| 完整回应 | 10% | 8% |
| 部分反应 | 56% | 42% |
| DoR中位数,月(95%CI) | 9.2(7.4,NR) | 10.2(7.5,NR) |
| 缩写:CI,置信区间;DoR,反应持续时间;人力资源,危险比;NR,未达到;ORR,总体响应率。研究者评估 了 PFS和ORR。 b基于分层对数秩检验。 | ||
图:COMBI-d研究中总体生存率的Kaplan-Meier曲线
 |
Mekinist(Trametinib)曲美替尼及Tafinlar(dabrafenib)达拉非尼哪里有卖?如何购买正版Mekinist(Trametinib)曲美替尼及Tafinlar(dabrafenib)达拉非尼?
香港致泰药业代理供应Mekinist(Trametinib)曲美替尼及Tafinlar(dabrafenib)达拉非尼。香港致泰药业是经香港政府卫生署注册的药品批发商,超过30年香港药房运营经验,与全球各大制药厂建立起良好的合作关系,专注于全球新特药品进出口业务,Mekinist(Trametinib)曲美替尼及Tafinlar(dabrafenib)达拉非尼最新价格欢迎与致泰药业联络查询。





















