美国FDA发布奥美沙坦相关安全性信息
2010年6月11日,美国食品药品监督管理局(FDA)发布信息称,正在对两项有关奥美沙坦(olmesartan,商品名Benicar)的临床试验进行评估。两项试验均发现,2型糖尿病患者使用抗高血压药奥美沙坦后出现心血管事件而死亡的发生率高于使用安慰剂的患者。FDA的评估正在继续,目前尚未得出奥美沙坦可增加死亡风险的结论,高血压患者使用奥美沙坦的利益仍大于潜在风险。
FDA评估的两项临床试验为ROADMAP和ORIENT研究,均为长期临床试验,受试者均患有2型糖尿病,给予奥美沙坦或安慰剂,以观察奥美沙坦的治疗是否可以减缓肾脏疾病的发生。两项研究均有预料之外的发现,即奥美沙坦组因心血管事件(心脏病、猝死或中风)死亡的数量较安慰剂组高。
奥美沙坦是血管紧张素Ⅱ拮抗剂类药物(ARBs),另一类作用相似的药物称为血管紧张素转化酶抑制剂(ACEIs),这两类药已经在许多项研究中被进行了评估,涉及数千名有心血管疾患风险的患者,如有心脏病史或心衰史的患者。这些试验中均未有心血管相关死亡风险升高的报道。实际上,一些研究表明ARBs和ACEIs在治疗某些心血管疾患高危风险的患者方面是非常有效的。
FDA建议患者不应随意停止奥美沙坦的治疗,除非有医生的要求。建议医疗专业人员按照说明书的指导处方该药品,并报告出现的不良事件。
数据摘要:
ROADMAP(奥美沙坦与预防糖尿病微量蛋白尿随机试验)是一项在欧洲开展的随机、双盲、安慰剂对照的多中心临床试验。试验包括了4447名患有2型糖尿病且至少有一种其他心血管疾病风险因素的患者,但这些患者没有明确的肾病诊断。患者被随机给予奥美沙坦(40mg/天)或安慰剂,并被允许使用ACEIs或ARBs以外的其他抗高血压药。
ROADMAP的研究目的是评估奥美沙坦是否能延缓微量蛋白尿的产生。绝大多数患者都有3-5种心血管疾病的风险因素,80%的患者使用了其他抗高血压药。奥美沙坦的中位暴露时间为39个月。
ORIENT(奥美沙坦降低糖尿病性肾病患者终末期肾病发病率试验)是一项在日本和香港开展的随机、双盲、安慰剂对照的多中心临床试验。2型糖尿病的患者(n=566)和有明确诊断的肾病患者被随机给予奥美沙坦(10-40mg/天)或安慰剂,并被允许使用包括ACEIs在内的其他抗高血压药,但不能使用ARBs。主要复合终点是患者的血清肌酸酐水平首次加倍、肾病终末期、所有原因导致的死亡。
两项研究均有意外的发现,即接受奥美沙坦组患者因心血管事件死亡的数量高于安慰剂组。主要心血管事件发生情况如下表所示。
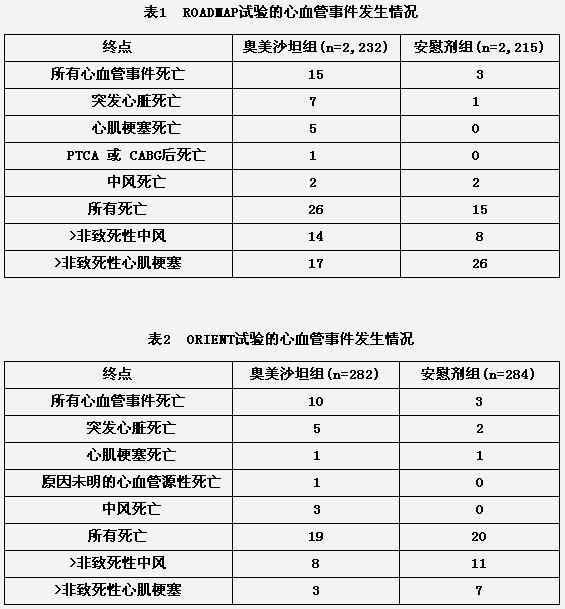
在考虑这些试验结果时,应注意到其他有关奥美沙坦及其他ARBs的试验未发现心血管相关死亡的风险升高,这一点很重要。
为评估与奥美沙坦相关的心血管死亡风险,FDA计划审查两项研究的主要数据和所有奥美沙坦的临床数据,以及通过其他方法更好地理解在ROADMAP和ORIENT研究中的发现。
(FDA网站)
- 2010.03.10
- 2010.02.27
- 2010.03.22
- 2010.02.22


























